قلدة كيماوية
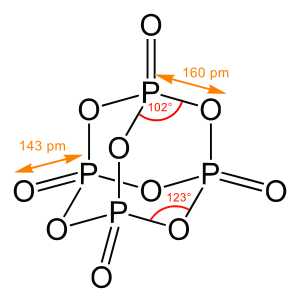
لقلدة لكيماوية (ب النڭليزية chemical structure) ديال موليكيلة هيّ لقلدة ف لفضاء ديال الدرات لي كيكوّنوها و الرابطات بيناتهوم. مول الشيمي كيحدّد لقلدة ديال شي موليكيلة ب تحديد التسطيرة ديالها، و يلا كان مومكين، تا لقلدة لإليكطرونية. لقلدة لكيماوية كاتمتّل ف لعادة ب الصيغية لقلداوية لي كاتبان ب ڭراف مرسوم ديال الدرات (على شكل نقاطي) و الروابط بيناتهوم (على شكل خطوط بساط ؤلا مضوبلين على حساب النوع ؤلا لقوة د الرابطة).[1] لعبار ديال الزوايا ؤلا لقنيتات بينات الروابط تا هيّ تقدر تلعب دور مهم. باش تّحدّد لقلدة لإليكطرونية كيخص يتحددو لوربيطالات (نقدرو تال واحد لحد نشبهوهوم ب لمدارات) ديال لإليكطرونات لي كاينين ف لموليكيلة.[2][3]
أي موليكيلة كيما كانت تقدر مبدئيا تمتّل لقلدة ديالها، من أبسط وحدة بحال تاني لوكسيجين ل أعقد لموليكيلات بحال لپروتينات و لحمض النووي.
لهدف اللولاني ديال لملاقية د لقلدة ديال مركب كيماوي هوّ تحديد الطوپولوجيا ؤلا لپاطيرن و الدرجة د الترابط ديال لموليكيلات و الدرات. لهدف التانوي لي كاتطمح ليه هاد لعملية هوّ تحديد لإحداتيات ف تلاتة د لأبعاد ديال الدرات لي كيكوّنو داك لمركب.[4]
النضريات ديال لقلدة لكيماوية بداو كيتطورو من 1858، من عند باحتين ف الشيمي بحال ؤڭيست كيكولي، أرشيبالد سكوط كوپر، و أليكساندر بوتليروڤ. هاد النضريات طرحو لفكرة بلي الدرات مامحطوطينش بشكل عشوائي، مي مستّفين ف واحد لقلدة ف لفضاء تلاتي لأبعاد لي يقدر بنادم يدرسها و يحددها و يمتّلها.[5]
- الطوپولوجيا لموليكيلية: كاتمتل لپاطيرن ديال الدرات و الترابطات بلا لمزايا التسطارية ديال لموليكيلة. نقدرو نمتّلو الطوپولوجيا لموليكيلية ب صيغة مسرحة مستاوية (ف جوج أبعاد). من بين الطرقان لي مخدّمين ف اللابو باش يحددو الطوپولوجيا لموليكيلية كاين:
- التسطار لموليكيلي: كاتمتّل التنضيم ف لفضاء ديال الدرات و لموليكيلات. طرقان مخبارية باش كاتحدد:
- لقلدة لإليكطرونية: كاتمتل الشكل ديال لوربيطالات لي شادين لإليكطرونات. طرقان ديال تحديدها:
- لڤولطاميترية الدوّارة cyclic voltammetry
- صونيط د السپين لإليكطروني electron spin resonance
- سپيكطروسكوپيا إليكطرونية
- ^ Haaland, Arne. (2008). Molecules and models : the molecular structures of main group element compounds. Oxford: Oxford University Press. OCLC 173809048. ردمك 978-0-19-923535-3.
- ^ Weinhold, Frank, 1941- (2005). Valency and bonding : a natural bond orbital donor-acceptor perspective. Landis, Clark R., 1956-. Cambridge, UK: Cambridge University Press. OCLC 59712377. ردمك 0-521-83128-8.CS1 maint: multiple names: authors list (link)
- ^ Gillespie, Ronald J. (Ronald James) (2001). Chemical bonding and molecular geometry : from Lewis to electron densities. Popelier, Paul L. A. New York: Oxford University Press. OCLC 43552798. ردمك 0-19-510495-1.
- ^ Wells, A. F. (Alexander Frank), 1912- (July 12, 2012). Structural inorganic chemistry (طبعة Fifth). Oxford. OCLC 801026482. ردمك 978-0-19-965763-6. مأرشيڤي من لأصل ف June 26, 2020. تطّالع عليه ب تاريخ June 8, 2023.CS1 maint: multiple names: authors list (link)
- ^ 36th congress of the German physicians and scientists 1861
